
Ilustrare de McCall Sarrett
Fie că uitați 20 de ani din viața voastră sau aveți aceeași conversație la fiecare cinci minute doar pentru a o uita de fiecare dată, deficiența de memorie poate afecta viața de zi cu zi. Poate fi unul dintre cele mai confuze aspecte ale neurodegenerării și este un simptom cheie al demenței.
Boala Alzheimer, de asemenea cunoscut ca si AD, este cea mai comună formă de demență, caracterizată prin dificultăți cognitive și pierderi de memorie. În prezent, nu există o tehnică clinică oficială pentru diagnosticarea AD, în afară de autopsie. Cu toate acestea, există două trăsături caracteristice ale țesutului cerebral al pacienților cu boala Alzheimer: beta amiloid (A?) plăci și încurcături neurofibrilare, ambele au oferit o cantitate substanțială de perspectivă asupra patologiei neurodegenerării.
„Încurcăturile neurofibrilare apar dintr-un defect al proteinelor numite proteine tau.”
A? is a protein that results from proteoliza of Proteina precursoare de amiloid (APP). This means that APP is cut into smaller fragments, one of which is the A? fragment. APP is cut into these pieces by enzymes called secretases, whose primary role is to cleave these proteins. Various secretases exist, but there is one that is significant for Alzheimer’s pathology – gamma secretase. Gamma secretase produces a special form of A?: A?-42, the most toxic form of the protein. Once broken up, these protein fragments begin to gather in the space outside of the cells. The key to the toxicity of these proteins is that they are characteristically “sticky”, so they begin to form aggregates. These aggregates continue to develop, and soon these amyloid beta plaques are everywhere, greatly impairing neuronal function.
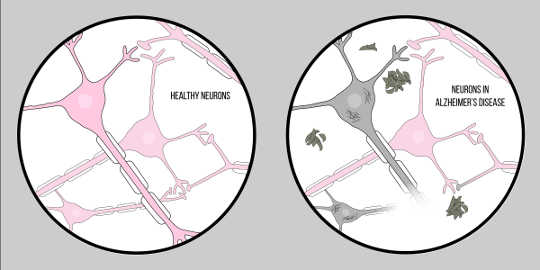 Figura de McCall Sarrett
Figura de McCall Sarrett
This impact of A? on neurological function has led to the Ipoteza amiloidă, o teorie bine recunoscută care propune o explicație pentru neurodegenerarea în Alzheimer.
Acum, pentru a doua caracteristică cheie: încurcăturile neurofibrilare. Încurcăturile neurofibrilare apar dintr-un defect al proteinelor numite proteine tau. Proteinele Tau servesc ca o punte între structurile numite microtubuli din interiorul celulei. Microtubulii sunt molecule de susținere care oferă formă și structură celulelor, în special axonilor. Proteinele Tau ajută acești microtubuli să ofere structura axonilor. Cu toate acestea, în cazul Boala AlzheimerO boală neurodegenerativă caracterizată prin pierderi neuronale i..., proteinele tau se separă și se acumulează în corpul celular, altfel cunoscut sub numele de soma. Acest lucru cauzează degenerarea axonilor, ceea ce face și mai dificilă comunicarea neuronilor. Această dificultate în comunicarea neuronală este similară cu efectele beta-amiloidului; cu toate acestea, este important de reținut că aceste încurcături diferă foarte mult de plăcile discutate anterior prin faptul că influențează comunicarea din interiorul celulei, spre deosebire de exterior.
„Oamenii de știință încă nu sunt siguri de mecanismul exact responsabil pentru patologia Alzheimer.”
Though both are extremely influential, A? and tau are not the only relevant factors when it comes to the pathology of Alzheimer’s. Studies have suggested that the Apolipoprotein E (APOE) genă may be as influential as A?. There are three major variants that encode for proteins: ApoE2, ApoE3, and ApoE4. ApoE4 has been shown to correlate with a decrease in synaptic pruning, while ApoE2 results in an increase. Both forms influence astrocite (important celule gliale în sistemul nervos) și sunt corelate cu rata lor de fagocitoză, procesul prin care astrociteCelulele gliale în formă de stea care au o serie de funcții, inclusiv... înghiți materialul celular. Fiecare variantă de ApoE influențează direct această rată de fagocitoză, ApoE2, rezultând o creștere, iar ApoE4, o scădere. Acest lucru sugerează că astrocitele pot fi mai puțin capabile să „șterge” resturile care plutesc în celulă atunci când sunt corelate cu ApoE4. Astfel, atunci când aceste plăci se acumulează, genotipul ApoE4 poate preveni eliminarea acestor agregate, contribuind la degenerare.
Beta amiloid, tau și diverse gene lucrează împreună pentru a provoca o problemă majoră de comunicare între celule, care este în esență boala pe care o cunoaștem sub numele de Alzheimer. O astfel de neurodegenerare este cel mai frecventă în zonele creierului asociate cu învățarea și memoria, dar în cele din urmă se răspândește în întregul creier. Odată cu această lipsă de comunicare vine o pierdere a sinapselor și, în cele din urmă, o scădere a materiei cerebrale. Astfel, este normal să vezi scăderea țesutului cerebral pe o RMNImagistica prin rezonanță magnetică, o tehnică de vizualizare a structurii... pe măsură ce boala progresează, dezvăluind că boala Alzheimer micșorează literalmente creierul. Modelele noastre actuale de învățare și memorie afirmă că sinapsele joacă un rol cheie în aceste procese, oferind o posibilă explicație a modului în care această patologie se corelează cu simptomele majore ale AD, cum ar fi pierderea memoriei.
Oamenii de știință nu sunt încă siguri de mecanismul exact responsabil pentru patologia Alzheimer. Multe metode inovatoare au fost cercetate în încercarea de a obține cunoștințe suplimentare despre acest punct patologic, una fiind biomarkerii lichidului cefalorahidian (LCR).
Levels of A? and tau can be measured in CSF through a procedure called a lumbar puncture, which collects cerebrospinal fluid. Increased levels of tau and reduced levels of A? are seen in patients with Alzheimer’s Disease. This is a result of the A? accumulations in the brain, which in turn results in a decreased concentration in the CSF. This data suggests that, in the future, doctors and scientists may be able to predict the cognitive state of a patient by examining protein levels in the CSF.
În prezent, nu există un tratament definitiv pentru boala Alzheimer. Cu toate acestea, cunoștințele tot mai mari despre proteinele patologice implicate, genele asociate și cercetările științifice în curs oferă speranță pentru un tratament eficient în viitor.
Ce progres credeți că sunt necesare pentru ca medicina să obțină un tratament pentru Alzheimer? Spune-ne în comentarii!
Acest articol a apărut inițial pe Cunoașterea neuronilor?
Despre autor
Khayla Black este boboc la Universitatea din New York din Shanghai intenționează să declare o specializare în Științe Neurale, cu o minoră în Știința Datelor, cu concentrare în inteligența artificială. În viitor, ea speră să obțină un MD/PhD și să devină un neuroștiință care studiază aspectele moleculare ale învățării și memoriei. În timpul ei liber, Khayla îi place să lucreze cu inițiativa MYELIN în cadrul IYNA, precum și să citească orice material legat de neuroștiință. În afară de studiul neuroștiințelor, îi place să alerge, să predea la școlile primare locale, să rezolve probleme de matematică și să bea cantități imense de cafea.
Cărți conexe
at InnerSelf Market și Amazon
Referinte
Lacor, P. N., Buniel, M. C., Furlow, P. W., Clemente, A. S., Velasco, P. T., Wood, M., . . . Klein, W. L. (2007, January 24). A? Oligomer-Induced Aberrations in Synapse Compoziția, forma și densitatea oferă o bază moleculară pentru pierderea conectivității în boala Alzheimer. Recuperate de la http://www.jneurosci.org/content/27/4/796
Murphy, M. P., & LeVine, H. (2010). Alzheimer’s Disease and the ?-Amyloid Peptide. Journal of Alzheimer’s Disease?: JAD, 19(1), 311. http://doi.org/10.3233/JAD-2010-1221
O'Brien, RJ și Wong, PC (2011). Procesarea proteinelor precursoare de amiloid și boala Alzheimer. Revizuirea anuală a neuroștiinței, 34, 185-204. http://doi.org/10.1146/annurev-neuro-061010-113613
Chung, W.-S., Verghese, PB, Chakraborty, C., Joung, J., Hyman, BT, Ulrich, JD, … Barres, BA (2016). Rol nou dependent de alele pentru APOE în controlul ratei de synapseConexiuni între neuroni de unde este transmis un semnal... tăierea de către astrocite. Procesele Academiei Naționale de Științe a Statelor Unite ale Americii, 113(36), 10186-10191. http://doi.org/10.1073/pnas.1609896113
Zetterberg, H. (2009, August 19). Amyloid ? and APP as biomarkers for Alzheimer’s disease. Retrieved from https://www.sciencedirect.com/science/article/pii/S0531556509001594?via=ihub























