
Îl vezi în reclame în fiecare zi: creme și loțiuni pentru a reduce ridurile, vopsele pentru a elimina părul gri și remedii pentru a reduce durerile musculare și articulare. Împreună cu aceste modificări ale nivelului de suprafață, îmbătrânirea afectează și fiziologia internă a corpului, inclusiv creșterea inflamației la nivelul creierului (Czirr & Wyss-Coray, 2012), degenerarea retinei (Hoh Kam et al, 2010) și permeabilitatea pereții intestinali (Ma și colab., 1992). Multe industrii sunt construite cu scopul de a inversa semnele îmbătrânirii. Dar există o modalitate de a contracara efectele îmbătrânirii în organism la un nivel mai profund decât vopsirea părului? Un grup de oameni de știință sugerează o modalitate unică de a întoarce ceasul înapoi asupra consecințelor legate de îmbătrânire în creier, folosind transferul de microbiotă fecală (FMT; Parker și colab., 2022).
FMT folosește principiile parabiozei (vezi un articol despre Knowing Neurons aici!) pentru a schimba microbiomii intestinali, definiti ca totalitatea bacteriilor și microorganismelor care trăiesc în intestinul sănătos (Sommer et al, 2013), între șoareci în vârstă și tineri. Pentru a-și testa ipoteza că utilizarea FMT pentru a modifica microbiomul intestinal modifică inflamația în creier și corp, Parker și colegii au folosit un model de șoarece cu șoareci de 3 luni (șoareci tineri) și șoareci de 24 de luni (șoareci în vârstă). ). Înainte de începerea experimentului, cercetătorii au colectat mai întâi materii fecale pentru a stabili nivelul de referință pentru microbiomii de șoareci tineri și în vârstă. Ulterior, șoarecilor li s-au administrat antibiotice timp de trei zile pentru a reduce bacteriile prezente în intestine. După tratamentul cu antibiotice, cercetătorii au recoltat o altă probă de fecale. În urma acestor pași inițiali, au fost efectuate două runde de FMT, în care fecalele lichefiate au fost administrate nazal și șoarecii au fost plasați în cuști care conțineau fecale în funcție de grupul lor experimental. Grupurile experimentale din acest studiu au fost șoareci în vârstă care au primit FMT de la șoareci tineri și șoareci tineri care au primit FMT de la șoareci în vârstă, în timp ce grupurile de control au fost șoareci tineri care au primit FMT de la alți șoareci tineri sau o soluție de control non-fecală (numită șoareci de control tineri) și șoareci în vârstă care primesc FMT de la alți șoareci în vârstă sau o soluție de control non-fecală (numită șoareci de control în vârstă). După FMT, fecalele au fost colectate cinci zile și două săptămâni mai târziu. Acest design experimental le-a permis investigatorilor să studieze modul în care vârsta microbiomului intestinal afectează procesele din creier, retină și intestine.
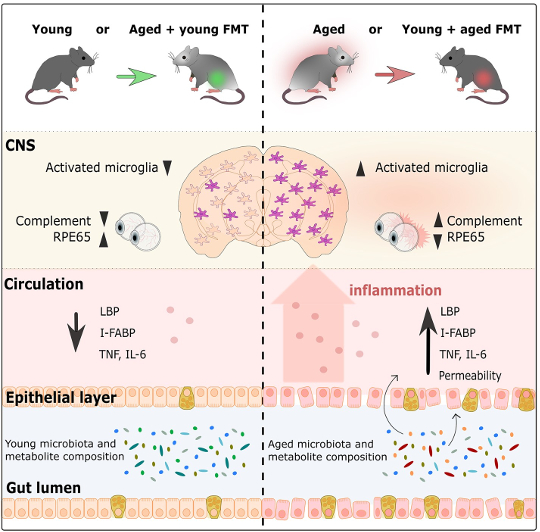
Rezumat grafic din Parker și colab., 2022
… infuzia unui șoarece îmbătrânit cu un microbiom tânăr anulează răspunsul imun observat odată cu vârsta.
Cercetătorii au investigat mai întâi modul în care FMT afectează răspunsul inflamator al microgliei, celulele imune rezidente ale creierului, în cortex și corpul calos (un pachet uriaș de neuroni care permite celor două părți ale creierului să comunice între ele) (Heneka et al, 2019). Erny și colab., 2015). Șoarecii de control în vârstă au avut microglia mai activată decât șoarecii de control tineri, ceea ce reflectă procesul normal de îmbătrânire. Cu toate acestea, șoarecii în vârstă cu microbiomi tineri au avut mult mai puțină activare a microgliei decât șoarecii de control în vârstă. În mod surprinzător, răspunsul microgliei a fost destul de similar cu cel observat la șoarecii martor tineri. Același model a fost arătat și în direcția opusă, deoarece șoarecii tineri cu microbiomi în vârstă au avut mult mai multă activare microglia decât șoarecii de control tineri, similar nivelurilor de activare observate la șoarecii de control în vârstă. Acest lucru arată că vârsta microbiomului influențează răspunsul imun din creier și că infuzia unui șoarece îmbătrânit cu un microbiom tânăr anulează răspunsul imunitar observat odată cu vârsta. În mod similar, oferind unui șoarece tânăr un microbiom îmbătrânit accelerează efectul îmbătrânirii asupra celulelor imune ale creierului.
… microbiomul influențează procesele legate de vârstă în retină…
Pe lângă examinarea creierului, cercetătorii au explorat și modul în care vârsta microbiomului intestinal afectează retina. În general, s-a demonstrat că, în comparație cu șoarecii tineri, șoarecii în vârstă au crescut inflamația la nivelul retinei. Cu toate acestea, după FMT, șoarecii în vârstă cu microbiomi tineri au avut niveluri de inflamație a retinei similare cu cele ale șoarecilor tineri de control. În conformitate cu descoperirile din creier, opusul a fost și adevărat. Șoarecii tineri cu microbiomi în vârstă au avut inflamație retiniană care seamănă cu șoarecii de control în vârstă. Microbiomul intestinal afectează și o altă parte a sistemului vizual: capacitatea fotoreceptorilor de a se regenera în retină cu ajutorul proteinei RPE65, a cărei producție este, de asemenea, cunoscută că scade odată cu vârsta (Cai et al, 2009). La șoarecii în vârstă cu microbiomi tineri, a existat o cantitate crescută de proteină RPE65 în comparație cu șoarecii de control în vârstă. De fapt, aceste niveluri de proteine au fost similare cu nivelurile de la șoarecii tineri. În plus, șoarecii tineri cu microbiomi în vârstă au avut mult mai puțin RPE65 decât șoarecii de control tineri, cu niveluri de proteine comparabile cu nivelurile observate la șoarecii în vârstă. În general, acest lucru arată că microbiomul are un impact asupra proceselor legate de îmbătrânire în retină, microbiomii tineri inversându-se și microbiomul îmbătrânit accelerând procesele asociate cu îmbătrânirea.
Un alt organ important, intestinele, nu sunt nici ele ferite de efectele îmbătrânirii: stratul celular care formează peretele intestinelor devine scurs în timp (Cui et al, 2019; Thevaranjan et al, 2017). Pe parcursul îmbătrânirii, stabilitatea peretelui intestinal scade și devine mai permeabilă, ceea ce permite bacteriilor să se scurgă în periferie, ceea ce, la rândul său, crește inflamația generală (Cui et al, 2019; Thevaranjan et al, 2017). În acest studiu, cercetătorii au arătat că vârsta microbiomului afectează stabilitatea pereților intestinali. La șoarecii în vârstă cu un microbiom tânăr, intestinele erau mai puțin permeabile decât șoarecii de control în vârstă. De fapt, permeabilitatea intestinală la șoarecii în vârstă cu un microbiom tânăr a fost similară cu permeabilitatea observată la șoarecii tineri. Șoarecii în vârstă cu microbiomi tineri au avut, de asemenea, niveluri de inflamație și dovezi de bacterii în sânge similare cu șoarecii tineri. Încă o dată, intestinele șoarecilor tineri cu microbiomi în vârstă s-au comportat similar cu șoarecii în vârstă cu microbiomi în vârstă, având un intestin mai scurs și mai multă inflamație decât șoarecii tineri cu microbiomi tineri. Aceste rezultate susțin ipoteza că microbiomii îmbătrâniți contribuie la creșterea permeabilității intestinale, ceea ce facilitează o creștere a inflamației, permițând bacteriilor să se scurgă în fluxul sanguin. Important, introducerea unui microbiom tânăr prin FMT inversează aceste efecte legate de vârstă.
… vârsta microbiomului intestinal afectează funcțiile creierului, retinei și intestinului.
Rezultatele studiului arată că vârsta microbiomului intestinal influențează funcțiile creierului, retinei și intestinului. Dar cum diferă microbiomele tineri și cei bătrâni unul de celălalt? Pentru a răspunde la această întrebare, cercetătorii au secvențiat ADN-ul microbiomului găsit în probele de fecale colectate pe parcursul experimentului. Microbiomul tânăr și în vârstă avea deja structuri genetice diferite înainte de apariția FMT, dar FMT a schimbat semnificativ compoziția genetică a ambilor microbiomi. Șoarecii tineri cu microbiomi în vârstă au avut o compoziție foarte asemănătoare cu șoarecii de control în vârstă, în timp ce compoziția genetică la șoarecii în vârstă cu microbiomi tineri a fost diferită de șoarecii de control în vârstă și, de asemenea, a fost diferită de șoarecii tineri cu microbiomi tineri - se aflau undeva la mijloc. Șoarecii de control în vârstă și șoarecii tineri cu microbiomi în vârstă au avut bacterii în cea mai mare parte din Oscillibacter și prevotella gen, Firmicutes filum și Lactobacillus johnsonii specii, în timp ce șoarecii de control tineri și șoarecii în vârstă cu microbiomi tineri au avut bacterii în cea mai mare parte din Bifidobacterium, Ackermansia, Parabacteroidii, Clostridium, și Enterococ grupuri. Când au investigat cauza potențială a acestor schimbări legate de vârstă, cercetătorii au descoperit că căile implicate în producția de lipide și vitamine (care se bazează pe metaboliții produși de bacterii), diferă între microbioamele în vârstă și cele tinere. Există un dezavantaj al acestei observații - schimbările în abundența diferitelor tipuri de bacterii și funcția lor potențială în intestin nu au fost de lungă durată, deoarece nu au existat diferențe mari între compoziția microbiomului la două săptămâni după FMT.
În general, acest studiu a arătat că microbiomul intestinal influențează procesele legate de vârstă în creier, ochi și intestin. Microbiomii îmbătrâniți, independent de vârsta șoarecelui primitor, au condus la mai multă inflamație în creier, retină și intestine, un potențial mai mic de regenerare a fotoreceptorilor din retină și mai multe bacterii care se scurg din intestine. Pe de altă parte, introducerea microbiomilor tineri la șoarecii în vârstă a inversat aceste efecte de îmbătrânire. Acest lucru se poate datora diferențelor în compoziția bacteriană a microbiomilor îmbătrâni și tineri și efectului pe care aceste modificări îl pot avea asupra căilor responsabile de producția de lipide și vitamine. O întrebare care nu a fost abordată în acest studiu a fost modul în care vârsta microbiomului afectează performanța cognitivă, deoarece nici șoarecii de control, nici șoarecii FMT nu s-au comportat diferit în testele de memorie comportamentală. Cercetările viitoare ar trebui să se concentreze și pe această întrebare, deoarece se știe că cogniția și memoria se diminuează odată cu vârsta, iar înțelegerea rolului microbiomului în declinul cognitiv legat de vârstă ar putea oferi o perspectivă importantă asupra posibilelor baze biologice. O altă direcție pe care ar trebui să o urmărească întrebările viitoare de cercetare ar fi impactul dietei asupra compoziției microbiomului intestinal. Studiile anterioare au arătat că diferitele diete modifică tipurile de microbi din intestin atât pe termen scurt (David et al., 2014), cât și pe termen lung (Wu et al., 2011). Dacă modificările dietei pot modifica compoziția microbiomului intestinal, ce se întâmplă dacă pot reduce aceste semne de îmbătrânire la nivelul creierului, retinei și intestinelor?
Dacă modificările dietei pot modifica compoziția microbiomului intestinal, ce se întâmplă dacă pot reduce aceste semne de îmbătrânire la nivelul creierului, retinei și intestinelor?
Despre autori
Compus de Holly Korthas, Ilustrat de Federica Raguseo, Editat de Johanna Popp, Sarah Wade, și Lauren Wagner
Referinte
Cai, X., Conley, SM și Naash, MI (2009). RPE65: rol în ciclul vizual, boala retinei umane și terapia genică. Genetica oftalmică, 30(2), 57-62. https://doi.org/10.1080/13816810802626399
Cui, H., Tang, D., Garside, GB, Zeng, T., Wang, Y., Tao, Z., Zhang, L. și Tao, S. (2019). Semnalizarea Wnt mediază afectarea diferențierii induse de îmbătrânire a celulelor stem intestinale. Recenzii și rapoarte de celule stem, 15(3), 448-455. https://doi.org/10.1007/s12015-019-09880-9
Czirr, E. și Wyss-Coray, T. (2012). Imunologia neurodegenerării. Journal of Clinical Investigation, 122(4), 1156-1163. https://doi.org/10.1172/JCI58656
David, L., Maurice, C., Carmody, R. et al. Dieta modifică rapid și reproductibil microbiomul intestinal uman. Natură 505, 559-563 (2014). https://doi-org.proxy.library.georgetown.edu/10.1038/nature12820
Erny, D., Hrab? de Angelis, AL, Jaitin, D., Wieghofer, P., Staszewski, O., David, E., Keren-Shaul, H., Mahlakoiv, T., Jakobshagen, K., Buch, T., Schwierzeck, V. ., Utermöhlen, O., Chun, E., Garrett, WS, McCoy, KD, Diefenbach, A., Staeheli, P., Stecher, B., Amit, I., & Prinz, M. (2015). Microbiota gazdă controlează în mod constant maturarea și funcția microgliei în SNC. Nature Neuroscience, 18(7), 965-977. https://doi.org/10.1038/nn.4030
Heneka MT (2019). Microglia ocupă locul central în bolile neurodegenerative. Recenzii despre natură. Imunologie, 19(2), 79-80. https://doi.org/10.1038/s41577-018-0112-5
Hoh Kam, J., Lenassi, E. și Jeffery, G. (2010). Vizualizarea ochilor îmbătrâniți: diverse locuri de acumulare de beta amiloid în retina șoarecelui îmbătrânit și reglarea în sus a macrofagelor. Plus unu, 5(10), e13127. https://doi.org/10.1371/journal.pone.0013127
Ma, TY, Hollander, D., Dadufalza, V., & Krugliak, P. (1992). Efectul îmbătrânirii și al restricției calorice asupra permeabilității intestinale. Gerontologie experimentală, 27(3), 321-333. https://doi.org/10.1016/0531-5565(92)90059-9
Parker, A., Romano, S., Ansorge, R., Aboelnour, A., Le Gall, G., Savva, GM, Pontifex, MG, Telatin, A., Baker, D., Jones, E., Vauzour , D., Rudder, S., Blackshaw, LA, Jeffery, G. și Carding, SR (2022). Transferul microbiotei fecale între șoarecii tineri și cei în vârstă inversează semnele distinctive ale îmbătrânirii intestinului, ochilor și creierului. Microbiome, 10(1), 68.
https://doi.org/10.1186/s40168-022-01243-w
Sommer, F. și Bäckhed, F. (2013). Microbiota intestinală - maeștri în dezvoltarea și fiziologia gazdei. Recenzii despre natură. Microbiologie, 11(4), 227-238. https://doi.org/10.1038/nrmicro2974
Thevaranjan, N., Puchta, A., Schulz, C., Naidoo, A., Szamosi, JC, Verschoor, CP, Loukov, D., Schenck, LP, Juri, J., Foley, KP, Schertzer, JD, Larché, MJ, Davidson, DJ, Verdú, EF, Surette, MG și Bowdish, DME (2017). Disbioza microbiană asociată vârstei promovează permeabilitatea intestinală, inflamația sistemică și disfuncția macrofagelor. Celulă gazdă și Microbi, 21(4), 455–466.e4. https://doi.org/10.1016/j.chom.2017.03.002
Wu, GD, Chen, J., Hoffmann, C., Bittinger, K., Chen, YY, Keilbaugh, SA, Bewtra, M., Knights, D., Walters, WA, Knight, R., Sinha, R. , Gilroy, E., Gupta, K., Baldassano, R., Nessel, L., Li, H., Bushman, FD și Lewis, JD (2011). Legarea tiparelor alimentare pe termen lung cu enterotipurile microbiene intestinale. Știință (New York, NY), 334(6052), 105-108. https://doi-org.proxy.library.georgetown.edu/10.1126/science.1208344
Acest articol a apărut inițial pe Cunoașterea neuronilor























